41. Kardio-onkologi
41.1 Baggrund
Prognosen for både kardiovaskulære og maligne tilstande er forbedret markant, og der er flere ældre i befolkningen generelt. Derfor er antallet af patienter med kardiovaskulær komorbiditet, hvilket kan komplicere et onkologisk behandlingsforløb, voksende, ligesom antallet af patienter med malign sygdom med risiko for kardielle bivirkninger under og efter deres behandling også er det.
Effektiv håndtering af disse patienter er nødvendig, hvorfor det overordnede mål med den kardio-onkologiske disciplin er at sikre, at patienter med malign sygdom får optimal kræftbehandling med mindst mulig risiko for kardiovaskulære bivirkninger.
En række farmaka, som anvendes i den onkologiske behandling, kan være forbundet med risiko for udvikling af kardiovaskulære komplikationer, som kan forekomme:
- akut (inden for dage) – debuterer typisk i forbindelse med intravenøs infusion og er typisk reversible
- subakut (op til 1 år) – progredierende manifestationer, der ofte er irreversible
- kronisk (flere år efter endt behandling) – komplikationerne er oftest progredierende med irreversible skader
Manifestationerne og risikoen afhænger af:
- dosis – såvel ved hver enkelt administration og kumuleret
- kombinationen af præparater og/eller samtidig strålebehandling
- individuelle forhold, især kendt eller uerkendt hjertesygdom
Kardiel påvirkning i forbindelse med kræftbehandling (kardiotoksicitet) kan give sig udslag i hjertesvigt (subklinisk eller klinisk), hypertension, iskæmisk hjertesygdom, arytmi eller tromboembolisk sygdom.
Tabel 41.1: Definitioner | |
Symptomatisk kardiotoksicitet (hjertesvigt)¹ | |
|---|---|
Meget svær | Hjertesvigt med behov for understøttende inotropi, mekanisk cirkulationsstøtte. |
Svær | Hjertesvigt med behov for hospitalisering |
Moderat | Behov for ambulant intensivering af diuretika og hjertesvigtsmedicin |
Mild | Milde hjertesvigtssymptomer uden behov for ændring i medicinsk behandling |
Asymptomatisk kardiotoksicitet (hjertesvigt) | |
Svær | Venstre ventrikels uddrivningsfraktion (LVEF)-reduktion til EF <40% |
Moderat | Ny LVEF-reduktion ≥10 procentpoint til LVEF på 40-49% |
Mild | LVEF ≥50% |
¹ defineret som i Kapitel 5: Kronisk hjertesvigt ² kardielle troponiner (cTnT/cTnI) >99 percentilens øvre grænseværdi | |
41.1.1 Generelle anbefalinger vedrørende kardio-onkologiske patienter
Til LVEF-vurdering anbefales i de europæiske kardio-onkologiske retningslinjer ekkokardiografi som den primære billeddiagnostiske modalitet suppleret med MR-skanning. Dog benyttes isotopkardiografi (MUGA)-skanninger som udgangspunkt på fleste danske centre i henhold til onkologiske retningslinjer. Det anbefales at arbejde hen imod, at ekkokardiografi benyttes til vurdering af LVEF med anvendelse af 3D og GLS.
Herudover anbefales det, at man arbejder hen imod etablering af multidisciplinære (MDT) kardio-onkologiske teams/klinikker på alle centre med behandling af både onkologiske, hæmatologiske og kardiologiske patienter.
41.2 Kardiovaskulær risikostratificering før kræftbehandling
Risikostratificering og overvejelse omkring forebyggelse af kardiovaskulær sygdom (CVD) bør gøres inden opstart af behandling i onkologisk/hæmatologisk regi. Der anbefales en klinisk vurdering og objektiv undersøgelse, inklusive afdækning af kardiel anamnese, og CVD risikoprofil forud for en eventuel henvisning til kardiologisk regi med henblik på vurdering af hjertesygdommens sværhedsgrad og om den er velbehandlet samt stillingtagen til forebyggende behandling under den planlagte onkologiske behandling.
Rekommandationer:
- En baseline CVD risikostratificering i form af anamnese inkl. kardielle symptomer.
- 12-aflednings EKG anbefales som en del af baseline risikostratificering. Et abnormt EKG bør konfereres med kardiolog forud for henvisning. Hvor QTc monitorering er nødvendig, anbefales Fridericias formel (QTcF).
- Måling af BNP/NT-proBNP og cTn anbefales kun, hvor der planlægges måling af disse biomarkører under onkologisk behandling mhp. monitorering af kardiotoksicitet.
41.3 Forebyggelse og monitorering under kræftbehandling
Det anbefales at optimere livsstilsrelaterede kardiovaskulære risikofaktorer og korrigere hypertension, diabetes (DM) og dyslipidæmi, samt underliggende CVD og modificerbare komorbiditeter.
Rekommandationer:
- håndtering af kardiovaskulære risikofaktorer i henhold til Kapitel 34: Forebyggelse af hjertesygdom, anbefales før, under og efter onkologisk behandling.
41.3.1 Kardiovaskulær monitorering under kræftbehandling
I det følgende omtales monitorering af kardiotoksicitet ved konkrete typer af kræftbehandling. For mere udførlig beskrivelse henvises til de europæiske guidelines med dansk endorsements.
Tabel 41.2: Anbefalede undersøgelser ved specifikke antineoplastiske præparater (se nedenstående for uddybende bemærkninger om specifikke risikogrupper) | ||||
| Baseline | Hver 3. måned | Efter 1. års behandling | Hver 6-12 måneder |
Antracyklin Eks. Doxorubicin Daunorubicin Epirubicin | LVEF-vurdering ved planlagt behandling med max kumulativ dosis | |||
HER2-targeteret behandling Eks. Trastuzumab Pertuzumab | LVEF-vurdering | LVEF-vurdering ved neoadjuvant eller adjuvant HER2-targeteret | Kan reduceres til hver 6. måned | |
Flouropyrimidin Eks. 5-FU Capecitabine | LVEF-vurdering ved tidligere symptomatisk CVD. | |||
VGEF-hæmmere Eks. Bevacizumab Ramucirumab Cabozantinib Lenvatinib Sunitinib | Måling af blodtryk | |||
BTK-hæmmere Eks. Ibrutinib Acalabrutinib | Måling af blodtryk. Gentages ved hvert klinisk besøg | |||
BCR-ABL TKI Eks. Imatinib Dasatinib Nilotinib Ponatinib | Objektiv undersøgelse, EKG, blodtryk, lipidprofil og HBA1c-måling ved | For nilotinib og ponatinib baseline undersøgelser | For nilotinib og ponatinib baseline undersøgelser | |
ICI Eks. Ipilimumab Nivolumab, Pembrolizumab | EKG og cTn (biomarkører gentages de første 3-4 cyklusser) | EKG og cTn | EKG og cTn hver 6. måned | |
PI Eks. Bortezomib Carfilzomib | Måling af blodtryk. Gentages ved hvert klinisk besøg | |||
ADT Eks. Abirateron Bicalutamid | Vurdering af kardiovaskulær risiko og estimering af 10 års risiko for CVD med SCORE2/SCORE2-OP til patienter uden tidligere CVD | Årlig vurdering af kardiovaskulær risiko | ||
ALK- og EGFR-hæmmere Eks. Alectinib Lorlatinib Osimertinib | Vurdering af kardiovaskulær risiko | |||
CAR-T og TIL | EKG, BNP/NT-proBNP og cTn | |||
HSCT | Kardiovaskulær risikovurdering og LVEF-vurdering | Kardiovaskulær risikovurdering (ikke ved 9 måneder) | Årlig kardiovaskulær risikovurdering | |
HER2 = Human epidermal receptor 2 targeteret behandling, VEGF = Vaskulære endothel vækstfaktor, BTK = Bruton tyrosin kinase hæmmere, BCR-ABL TKI = Multi-targeterede kinase hæmmere targeterende BCR-ABL, PI = Proteasomhæmmere, | ||||
Antracyklin-behandling
Antracyklin-induceret kardiel dysfunktion er en dosisafhængig og akkumulerende proces med variabel præsentation, med eller uden symptomer.
Rekommandationer:
- Hos patienter som vurderes værende i meget høj risiko for kardiotoksicitet kan repetitiv LVEF-vurdering overvejes (især hos børn/unge, patienter med kendt CVD eller høj dosis af antracyklin).
Human epidermal receptor 2 (HER2) targeteret behandling
HER2-targeteret behandling kan lede til venstre ventrikel dysfunktion hos op til 15–20% af patienterne.
Rekommandationer:
- Vurdering af LVEF hver 3. måned.
- Ved metastatisk HER2-positiv sygdom kan overvågningen reduceres til hver 6. måned efter det første års behandling, hvis patienten forbliver uden kardiovaskulær toksicitet.
Fluoropyrimidin-behandling
Fluoropyrimidin-induceret kardiotoksicitet kan give anledning til angina pectoris, iskæmi-relaterede EKG-abnormaliteter, hypertension, Takotsubo-syndrom og myokardieinfarkt. Der ses sjældnere forekomst af myokardit, rytmeforstyrrelser og perifer arteriel toksicitet (Raynaud's fænomen og iskæmisk stroke).
Rekommandationer:
- Baseline vurdering af kardiovaskulær risiko, herunder lipidprofil, HbA1c-måling og SCORE2/SCORE2-OP eller tilsvarende kan overvejes før opstart af behandling mhp. optimal behandling af kardiovaskulære risikofaktorer.
Vaskulære endothel vækstfaktor (VEGF) hæmmere
Anvendelse er associeret med hypertension, hjertesvigt, forlængelse af QTc og akutte vaskulære events. Hypertension er den mest rapporterede bivirkning, og kan opstå inden for timer eller dage, er dosisafhængig og reversibel ved ophør af behandling. Akutte arterielle events (aortadissektion, stroke, arteriel trombose, akut koronart syndrom (AKS), vasospasme) og venøs tromboemboli (VTE) kan også komplicere behandlingen.
Rekommandationer:
- Overvågning af QTc månedligt de første 3 måneder og derefter hver 3-6 måneder, hos patienter med moderat eller høj risiko for forlænget QTc.
- Regelmæssig måling af blodtryk og aggressiv antihypertensiv behandling, således at højt BT så vidt muligt ikke bliver bestemmende for reduktion/pausering i kræftbehandling.
Multitargeterede kinase-hæmmere targeterende BCR-ABL (BCR-ABL TKI)
Toksiciteter relateret til BCR-ABL TKI er unikke for hvert præparat. Dasatinib er associeret med pulmonal hypertension, hjertesvigt og pleura- og perikardieeksudat, mens nilotinib og ponatinib generelt er forbundet med vaskulære events. Anden generations BCR-ABL TKI-behandling kan føre til forlænget QTc. Risikoen for kardiotoksicitet er højere hos patienter >65 år, patienter med diabetes mellitus, hypertension eller eksisterende koronarsygdom.
Rekommendationer:
- optimering af kardiovaskulære risikofaktorer anbefales
Bruton tyrosin kinase (BTK) hæmmere
Ibrutinib er forbundet med blødningstendens, infektioner og en øget risiko for hypertension, atrieflimren og hjertesvigt. Ibrutinib kan også forårsage ventrikulære rytmeforstyrrelser uden at forlænge QT.
Rekommandationer:
- Anamnese vedrørende kardielle symptomer og måling af blodtryk anbefales ved hvert klinisk besøg.
- Ekkokardiografi anbefales hos alle patienter, der udvikler atrieflimren under behandling med BTK-hæmmer.
- Opportunistisk screening for atrieflimren ved at tage pulsen anbefales ved hvert klinisk besøg under behandling med BTK-hæmmer. EKG kun ved klinisk mistanke.
Myelomatose-behandling
Denne gruppe omfatter immunmodulerende lægemidler (IMiD), dexamethason, proteasomhæmmere (PI) og monoklonale antistoffer (f.eks. daratumumab). PI er associeret med hypertension, hjertesvigt, AKS, rytmeforstyrrelser, pulmonal hypertension og tromboemboliske events. Patienter med myelomatose er i øget risiko for VTE, især ved kombinationsterapi med PI og iMiD.
Rekommandationer:
- anamnese vedrørende kardielle symptomer og måling af blodtryk anbefales ved hvert klinisk besøg
- måling af BNP/NT-proBNP anbefales før opstart af PI-behandling hos patienter, som vurderes værende i høj kardiovaskulær risiko
- måling af BNP/NT-proBNP og cTn ved baseline og hver 3-6 måneder anbefales hos patienter med amyloid letkæde kardiel amyloidose
- terapeutiske doser af LMWH anbefales til patienter med myelomatose med tidligere VTE
- profylaktiske doser af LMWH anbefales til patienter med myelomatose med risikofaktorer for VTE (med undtagelse af tidligere VTE) i min. de første 6 måneder af behandlingen
Risikofaktorer for VTE hos patienter med myelomatose
Tabel 41.3: Risikofaktorer for VTE hos patienter med myelomatose | |
Patient-relaterede risikofaktorer | Myelomatose-relaterede risikofaktorer |
Tidligere VTE | Avanceret sygdomsstadie |
Akut infektion | Erytropoietin-stimulerende lægemidler |
Autoimmun sygdom | Høje doser af Dexamethason |
Centralt venekateter | Hyperviskositetssyndrom |
Kronisk nyresygdom | Thalidomid/lenalidomid/ponalidomid |
Rygning | |
CVD | |
Diabetes Mellitus | |
Generel kirurgi | |
Arvelig trombofili | |
Immobilisation, kirurgi, traume | |
Fedme (BMI >30 kg/m2) | |
Rapidt accelererende fibrosarkom (RAF) hæmmere og mitogen-aktiveret extracellulær signal-reguleret kinase (MEK) hæmmere.
Hypertension, lungeemboli og kardiel dysfunktion er associeret med alle kombinationer af RAF- og MEK-hæmmere. QTc-forlængelse er associeret til samtidig administration af cobimetinib og vemurafenib. Behandling med RAF-hæmmer alene eller i kombination med en MEK-hæmmer er forbundet med en øget risiko for myokardieinfarkt og atrieflimren.
Rekommandationer:
- anamnese vedrørende kardielle symptomer og måling af blodtryk anbefales ved hvert klinisk besøg i de første 3 måneder af behandlingen og derefter månedligt
- hos patienter behandlet med cobimetinib/vemurafenib, anbefales EKG efter 2 og 4 uger efter opstart af behandling og hvert 3. måned derefter mhp. vurdering af QTc
Immun checkpoint inhibitor (ICI)/Immunterapi
ICI-relateret kardiotoksicitet kan give fulminant myokarditis, perimyokarditis, kardiel dysfunktion eller myokardieinfarkt. Anden kardiotoksicitet under ICI-behandling inkluderer AV-blok, supraventrikulære og ventrikulære rytmeforstyrrelser, pludselig død, Takotsubo-lignende syndrom, non-inflammatorisk hjertesvigt, hyperkolesterolæmi, perikarditis, perikardieeksudat, iskæmisk stroke og VTE.
Rekommandationer:
- opfølgende kardiologisk vurdering med ekkokardiografi anbefales ved symptomer, betydende troponin-stigning eller EKG-forandringer, telemetri
Androgen deprivation terapi (ADT) for prostatakræft
De vigtigste ADT-relaterede kardiotoksiciteter er hypertension, DM, iskæmisk hjertesygdom og kardiel dysfunktion.
Rekommandationer:
- baseline og serielle EKG'er anbefales hos patienter med risiko for QTc-forlængelse under ADT-behandling (se sektion 41.4.9 om ”Lang QT-syndrom og ventrikulære arytmier”)
- såfremt der mistænkes betydende QTc-forlængelse eller signifikant øgning i QTc fra baseline bør fund drøftes med kardiolog
Cyclin-dependent kinase (CDK) 4/6 hæmmere
CDK 4/6 hæmmere er associeret med QTc-forlængelse, især ved behandling med ribociclib. Hos patienter, der allerede har eller er i øget risiko for at udvikle QTc-forlængelse, bør risici og fordele af behandling med ribociclib diskuteres på MDT. Anvendelse af ribociclib i kombination med lægemidler med kendt QTc-forlængende effekt og/eller stærke inhibitorer eller induktorer af CYP3A4 bør helt undgås.
Rekommandationer:
- QTc-monitoring anbefales ved baseline og efter 14 og 28 dage hos patienter i behandling med CDK 4/6 hæmmere
- QTc-monitoring anbefales hos patienter i behandling med CDK 4/6 hæmmere i forbindelse med øgning af dosis
Anaplastisk lymfom kinase (ALK) hæmmere og epidermal growth factor receptor (EGFR) hæmmere
ALK-hæmmere kan forårsage sinusbradykardi, AV-blok, QTc-forlængelse, hypertension, hyperglykæmi og dyslipidæmi. AKS og hjertesvigt er også beskrevet ved behandling med crizotinib, omend sjældent forekommende. EGFR-hæmmeren, Osimertinib, er associeret med en øget risiko for QTc-forlængelse, atrieflimren, VTE, venstre ventrikel dysfunktion og hjertesvigt.
Rekommandationer:
- baseline LVEF-vurdering kun ved symptomer og abnormt EKG
- opfølgende kardiologisk vurdering med EKG og ekkokardiografi anbefales ved symptomer
Chimeric antigen receptor-T-cellebehandling (CAR-T) og tumour-infiltrating lymphocytes (TIL) behandling
Kardiotoksiske komplikationer relateret til CAR-T inkluderer venstre ventrikel dysfunktion, hjertesvigt, arytmi, perikardieeksudat, Takotsubo syndrom og hjertestop. Disse komplikationer er oftest forbundet med forekomsten af cytokin-frigivelsessyndrom (CRS). CRS bør mistænkes, når en patient udvikler feber, med eller uden takykardi, takypnø, hypotension, hypoxi og/eller anden organdysfunktion timer til dage efter behandlingen. TIL-behandling er relateret til direkte myokardiel og vaskulær toksicitet.
Rekommandationer:
- baseline LVEF vurdering er ikke obligat ved fravær af symptomer og normalt EKG
- måling af BNP/NT-proBNP, cTn og ekkokardiografi anbefales for patienter, der udvikler CRS med feber OG hypotension OG/ELLER hypoxi med behov for minimum low-flow nasalt ilttilskud
41.3.2 Stråleterapi
Radioterapi er en lokal behandling og direkte stråleskade forekommer kun i det bestrålede område. Risikoen for kardiotoksicitet afhænger af dosis og lokalisation. Analyser af store patientmaterialer finder en forøget relativ risiko for hjertesygdom på 0,10 pr. Gy og for hjertedød på 0,08 pr. Gy. Komplikationerne omfatter skader både på peri-, endo- og myokardium samt koronarkarrene med udvikling af fibrose eller småkarsskade.
Stråleskaderne manifesterer sig ofte som
- iskæmisk hjertesygdom (ofte >10 år efter endt behandling)
- hjerteklapsygdom (oftest aortastenose) (ofte >10 år efter endt behandling)
- perikarditis (kan forekomme subakut under strålebehandlingen) med risiko for udvikling til constrictio cordis som senfølge
- ledningsforstyrrelser med risiko for udvikling af arytmier (sjældent med moderne strålebehandling og ofte >10 år efter endt behandling)
Stråleinduceret hjertesygdom ses hyppigst efter strålebehandlet brystkræft, lunge- og lungehindekræft, spiserørskræft, kræft i thymus, lymfomer med mediastinal involvering, samt medulloblastom behandlet med total cranio-spinal strålebehandling.
Risikofaktorer omfatter bl.a.
- stråledosis (total dosis >35Gy / >2Gy pr. dag)
- strålefeltets størrelse og retning (nær hjertet)
- tumor tæt ved hjertet
- ung alder på behandlings tidspunkt og samtidig behandling med kardiotoksisk kemoterapi (især antracyklin)
Stråleinduceret hjerteskade forebygges ved anvendelse af moderne avanceret stråleteknik, hvorved hjertedosis kan holdes på et minimum, medmindre svulsten ligger helt tæt op mod hjertet. Den samlede stråledosis holdes så lavt som muligt, og der gives små enkeltfraktioner. Stråleinduceret kardiotoksicitet accelererer eksisterende hjertesygdom, og derfor anbefales tæt kontrol og optimering af modificerbare kardiovaskulære risikofaktorer for CVD før og efter stråleterapi.
41.3.3 Hæmatopoietisk stamcelletransplantation (HSCT)
I den tidlige fase efter HSCT (inden for 100 dage) er den mest almindelige kardiovaskulære event atrieflimren, sjældnere hjertesvigt, hypertension, hypotension, perikardieeksudat eller VTE. Senere toksiciteter inkluderer DM, dyslipidæmi, metabolisk syndrom, hypertension, hjertesvigt, koronarsygdom, ledningsforstyrrelser og perikardieeksudat. Akut graft vs. host sygdom er associeret med trombose og inflammatorisk myokardieskade (myokarditis, hjertesvigt, ledningsforstyrrelser, arytmi og perikardieeksudat).
41.3.4 Andre onkologiske behandlingstyper
Andre typer af onkologisk behandling kan også udløse klinisk relevante kardiotoksiske events. Cyclophosphamid (høje doser >140mg/kg), cisplatin, ifosfamid og taxaner (paclitaxel og docetaxel) kan forårsage myokardiel dysfunktion og hjertesvigt. Ved platinbaseret kemoterapi ses vaskulær sygdom (vasospasme, myokardieinfarkt og venøs og arteriel trombose). Livsstilsinterventioner og tæt overvågning af kardiovaskulære risikofaktorer anbefales under og efter behandlingen.
41.4 Diagnosticering og håndtering af akutte og subakutte kardiovaskulære toksiciteter under kræftbehandling
I det følgende omtales diagnosticering og behandling af kardiotoksicitet ved konkrete typer af kræftbehandling.
41.4.1 Antracyklin behandling
Relaterer sig til systolisk dysfunktion af venstre ventrikel, som kan vise sig klinisk eller konstateres hos asymptomatiske patienter ved follow-up undersøgelser i forløbet.
Konkrete rekommandationer:
Ved antracyklin-induceret symptomatisk systolisk dysfunktion
- Patienten tilbydes hjertesvigtsbehandling – se Kapitel 3: Kronisk hjertesvigt.
- Antracyklin-behandling stoppes hos pt. med svær systolisk dysfunktion.
- Antracyklin-behandling pauseres hos pt. med moderat systolisk dysfunktion. Beslutning om genopstart af behandling besluttes individuelt på MDT-konference.
- Patienter med mild systolisk dysfunktion diskuteres på MDT-konference mhp. fortsættelse eller pausering af antracyklin-behandling.
Ved antracyklin-induceret asymptomatisk systolisk dysfunktion
- Pausering og hjertesvigtsbehandling hos patienter med moderat-svær systolisk dysfunktion.
- Beslutning om genopstart af behandling diskuteres på MDT konference.
- Fortsættelse af behandling hos asymptomatiske patienter med mild systolisk dysfunktion bør vurderes individuelt.
Der anbefales tæt kardiel monitorering, f.eks. forud for hver anden serie samt ved genopstart af antracyklin-behandling hos patienter med antracyklin-induceret systolisk dysfunktion.
Data tyder på at kardielle langtids-komplikationer (>1-5 år) af antracyklin-behandling er betydende, men på nuværende tidspunkt kan regelret kardiologisk opfølgning ikke anbefales.
41.4.2 Human epidermal receptor 2 behandling (HER-2)
Relaterer sig til systolisk dysfunktion af venstre ventrikel.
Konkrete rekommandationer:
HER-2 induceret symptomatisk systolisk dysfunktion
- Patienten tilbydes hjertesvigtsbehandling – se Kapitel 5: Kronisk Hjertesvigt og Kapitel 8: Myokardiesygedomme.
- HER-2 behandling pauseres hos pt. med moderat-svær systolisk dysfunktion. Beslutning om genopstart diskuteres på MDT konference efter bedring i den systolisk funktion og ingen symptomer.
- Patienter med mild systolisk dysfunktion tilbydes hjertesvigtsbehandling og diskuteres på MDT mhp. fortsættelse eller pausering af HER-2 behandling.
HER-2 induceret asymptomatisk systolisk dysfunktion
- HER-2 behandling pauseres og hjertesvigtsbehandling opstartes hos pt. med svær systolisk dysfunktion. Beslutning om genopstart diskuteres på MDT konference.
- HER-2 behandling fortsættes under tættere monitorering, f.eks. hver anden cyklus, i tilfælde af mild systolisk dysfunktion (LVEF>50%).
Der anbefales tæt kardiel monitorering ved genopstart af HER-2 behandling hos patienter med nuværende eller tidligere HER-2 induceret systolisk dysfunktion.
41.4.3 Immun checkpoint inhibitor (ICI)/immunterapi
Relaterer sig til myokarditis, som er en sjælden men alvorlig komplikation med en høj mortalitet. Klinisk ses tilfælde med uforklaret let troponin-forhøjelse, som ikke frembyder et myokarditis billede.
Myokarditis ses hyppigst i begyndelsen af behandlingsforløbet, men sene tilfælde forekommer også.
Udredning i henhold til Kapitel 8: Myokardiesygdomme, Afsnit 8.6 Myokarditis. Andre immunterapi relaterede toksiciteter er beskrevet i ovenstående afsnit 3.
Konkrete rekommandationer:
- Ved mistænkt ICI myokarditis pauseres immunterapi indtil diagnosen er afklaret ved EKG, troponin og billeddiagnostik (ekkokardiografi/hjerte-MR)
- Afbrydelse af immunterapi anbefales ved ICI myokarditis.
- Patienter med symptomatisk ICI myokarditis bør i den akutte fase indlægges i telemetri pga. risiko for AV-blok og takyarytmi.
- Tidlig opstart af behandling med højdosis i.v. steroid (f.eks. som pulsbehandling methylprednisolon 500-1000mg x 1 dgl. i minimum 3 dage) når ICI myokarditis bekræftes (skift til p.o. kortikosteroid kan overvejes ved klinisk bedring).
- Fortsat behandling med højdosis steroid indtil resolution af symptomer, systolisk funktion, arytmier og troponin.
- Evt. ”second-line” immundæmpende behandling ved manglende respons i samarbejde med onkolog.
- I tilfælde af fulminant myokarditis indlæggelse på intensiv afdeling, højdosis i.v. steroid og optimal kardiel understøttende behandling inkl. evt. mekanisk cirkulatorisk støtte.
- Hos patienter med tidligere ukompliceret ICI relateret myokarditis anbefales genopstart af immunterapi diskuteret på MDT konference.
På grund af den alvorlige prognose ved ICI-relateret myokarditis anbefales på lav tærskel henvendelse til kardio-onkologisk center ved mistanke om eller konfirmeret tilfælde af ICI myokarditis.
41.4.4 Takotsubo syndrom
Malign sygdom og stress i forbindelse hermed samt visse onkologiske behandlinger (5-FU, ICI, VEGFi) er erkendte prædisponerende faktorer/triggere for Takotsubo syndrom.
Udredning af Takotsubo syndrom hos en patient med malign sygdom består af biomarkører, EKG og ekkokardiografi. Indikation for hjerte-MR vurderes individuelt. Der anbefales generelt hjerte-CT eller KAG for at udelukke koronarsygdom, men det afhænger helt af den enkelte patient samlet set.
Det anbefales at pausere evt. udløsende onkologisk behandling og at undgå QT prolongerende medikamina i den akutte fase af Takotsubo syndrom. Steroid behandling overvejes ved ICI-relateret Takotsubo syndrom.
Genopstart af evt. udløsende onkologisk behandling diskuteres på MDT konference inkl. plan for overvågning af den kardielle funktion.
41.4.5 Koronarsygdom - AKS
Diagnose af AKS vurderes i henhold til Kapitel 1: Akut koronart syndrom. Da præsentationen kan være asymptomatisk, kræves øget opmærksomhed hos patienter med malign sygdom i høj kardiovaskulær risiko i behandling med potentielt vaskulært kardiotoksiske præparater.
Varetagelsen af AKS hos patienter med malign sygdom kan være vanskeliggjort som følge af frailty, øget blødningsrisiko, trombocytopeni, øget tromboserisiko og behov for fremtidige invasive diagnostiske eller terapeutiske procedurer. Det anbefales at tilstræbe en individualiseret behandlingsplan under hensyntagen til kræftstatus, prognose og patientpræferencer.
Konkrete rekommandationer
- invasiv strategi anbefales hos patienter med STEMI og høj-risiko AKS hos patienter med forventet livslængde>6 mdr.
- midlertidigt ophør med kræftbehandling anbefales ved mistanke om at denne er medvirkende faktor til AKS.
- indikationen for samt type af trombocythæmmer vurderes individuelt under hensyntagen til AKS-genese.
I tilfælde af AKS som følge af kræftbehandling bør genopstart diskuteres på MDT konference.
I tilfælde af (mistanke om) AKS som følge af vasospasme (ofte 5-FU behandling) og mangel på ligeværdig alternativ behandling, kan den onkologiske behandling ofte foregå under indlæggelse til telemetri efter udelukkelse af iskæmisk hjertesygdom og opstart af profylaktisk behandling (langtidsvirkende nitrater eller calciumantagonister).
41.4.6 Koronarsygdom – kronisk koronart syndrom
Varetagelse af kronisk koronart syndrom i henhold til Kapitel 3: Kronisk koronart syndrom. Som for AKS bør indikationen for trombocythæmmerbehandling vurderes individuelt, herunder evt. PCI.
41.4.7 Hjerteklapsygdom
Varetages i henhold til Kapitel 6: Hjerteklapsygdom idet prognose og patientpræferencer tages i betragtning.
Kendt hjerteklapsygdom er associeret med øget risiko for kardiel komplikation ved kræftbehandling, herunder ved kræftkirurgi. Hos patienter med svær hjerteklapsygdom kan MDT konference forud for onkologisk behandling være nødvendig mhp. kardiel behandlingsplan. Generelt vil der være et kardielt behandlingstilbud til patienter med forventet restlevetid >1 år.
41.4.8 Kardiel arytmi - atrieflimren
Mange medicinske kræftbehandlinger er associeret med en øget risiko for atrieflimren. Atrieflimren er associeret med øget risiko for tromboemboli og hjertesvigt hos patienter med malign sygdom, foruden øget mortalitetsrisiko og højere forekomst af alvorlig blødning inkl. intrakraniel blødning i tilfælde af AK-behandling.
Behandling af atrieflimren følger Kapitel 15: Atrieflimren og atrieflagren, dog opmærksomhed på at CHA2DS2-VASC risikostratificering formentlig underestimerer den faktiske risiko for tromboemboli. Blødningsrisiko, co-morbiditet og prognose må medtages i vurderingen af indikationen for AK-behandling.
Konkrete rekommandationer
- langvarig AK-behandling anbefales i tilfælde af CHA2DS2-VASC ≥2 (mænd) eller ≥3 (kvinder), under hensyntagen til blødningsrisiko
- langvarig AK-behandling bør overvejes i tilfælde af CHA2DS2-VASC ≥1 (mænd) eller ≥2 (kvinder), under hensyntagen til blødningsrisiko
- valg af DOAC som AK-behandling bør tage hensyn til mulig betydende lægemiddel-interaktion med kræftbehandling (www.cat-app.dk).
- trombocythæmmer behandling eller LMWH i profylaktisk dosis anbefales ikke.
41.4.9 Lang QT-syndrom og ventrikulære arytmier
Ventrikulær arytmi behandles i henhold til Kapitel 18:Ventrikulær arytmi. Særlig opmærksomhed kræves på mulige interaktion mellem anti-arytmisk og medicinsk kræftbehandling. Betablokker vil ofte være foretrukken første valg behandling, især i tilfælde af nedsat systolisk funktion af venstre ventrikel. Amiodaron bør overvejes i tilfælde af strukturel hjertesygdom eller hæmodynamisk instabilitet.
Konkrete rekommandationer:
- QTc-beregning anbefales foretaget med Fridericias formel.
- Ophør med QTc-forlængende kræftbehandling anbefales hos patienter, der udvikler TdP eller sustained VT under behandling.
- Pausering med QTc-forlængende medicinsk kræftbehandling anbefales hos patienter der udvikler QTcF≥500 ms og dgl. EKG tages indtil resolution af QT-forlængelse.
- Pausering af QTc-forlængende stoffer, korrektion af elektrolytforstyrrelser og andre risikofaktorer (www.crediblemed.org) hos pt. der udvikler QTcF≥500 ms.
- Ugentlig EKG anbefales hos asymptomatiske patienter der behandles med QTc forlængende terapi og udvikler QTcF på 480-500 ms.
- 12-afledningers EKG anbefales efter dosisøgning af potentielle QTc-forlængende farmaka.
- Genopstart af QTc-forlængende terapi hos pt. der har udviklet signifikant QTc-forlængelse diskuteres på MDT konference. mhp. mulighed for alternativ behandling, reduceret dosering og monitorering af EKG i tilfælde af genopstart.
Implanterbar-kardioverter defibrillator (ICD) overvejes hos patienter med en forventet restlevetid på mere end 1 år, især hos patienter genoplivet efter hjertestop.
41.4.10 Hypertension
Hypertension hos patienter med malign sygdom kan være relateret til kræftbehandling (ofte VEGFi, TKI), anden medicinsk behandling (steroid, NSAID) samt faktorer som stress, smerter, nyrepåvirkning m.m.
Behandling i henhold til Kapitel 27:Hypertension. Pausering af kræftbehandling vurderes individuelt. Dog bør hypertension behandles aggressivt, således at højt BT så vidt muligt ikke bliver bestemmende for reduktion/pausering i kræftbehandling.
41.4.11 Venøs tromboemboli (VTE)
VTE hos kræftpatienter er hyppig og udgør ca. 30% af alle VTE-tilfælde. Der henvises til Kapitel 12: Lungeemboli og dyb venetrombose for rekommandationer vedr. udredning og behandling af VTE.
Udvalgte cancerpatienter (herunder visse myelomatosepatienter) med særlig høj risiko for VTE kan tilbydes tromboseprofylakse med lavmolekylært heparin i forbindelse med antineoplastisk behandling
41.4.12 Pulmonal hypertension (PAH)
Flere medicinske kræftbehandlinger er associeret med PAH. Diagnostik og behandling i henhold til Kapitel 13: Pulmonal hypertension.
41.4.13 Perikardiesygdom
Perikarditis og perikardieeksudat kan være relateret til en række forskellige kræftbehandlinger og thorakal strålebehandling. Diagnostik og behandling i henhold til Kapitel 9: Perikardiesygdomme.
41.6 Opfølgning og kroniske kardiovaskulære komplikationer efter kræftbehandling
41.6.1 Baggrund
Den bedre overlevelse blandt kræftpatienter har betydet en stigning i incidensen af kroniske kardiovaskulære komplikationer på baggrund af kræftbehandling. Følgende højrisiko tilstande er defineret som risikofaktorer for fremtidig kardiovaskulær sygdom hos patienter med afsluttet kræftbehandling:
- behandling med doxorubicin (eller doxorubicin ækvivalent) >250mg/m2, mediastinal bestråling >15GY samt højrisiko hæmatopoietisk stamcelletransplantation.
- moderat eller svær kardiotoksicitet udviklet under antineoplastisk behandling.
- nye kardiovaskulære symptomer og nye asymptomatiske abnormiteter fundet ved ekkokardiografi og/eller biomarkører efter afsluttet kræftbehandling.
På baggrund af ovenstående er der en række anbefalinger om kardiovaskulær opfølgning efter endt antineoplastisk behandling.
41.6.2 Opfølgning efter afsluttet kardiotoksisk kræftbehandling
Hos patienter, hvor langtidsprognosen vurderes god efter afsluttet kardiotoksisk kræftbehandling, gælder en række anbefalinger for de første 12 måneder:
Patientuddannelse
- at uddanne patienter i en sund livsstil samt at understøtte udviklingen af denne
- at uddanne patienter således, at de kan identificere tidlige tegn og symptomer på kardiovaskulær sygdom
Kliniske kontroller
- vurdering af kardiovaskulære risikofaktorer anbefales det første år efter afsluttet kræftbehandling
- opfølgning med EKG i tilfælde af udviklet QT-forlængelse eller LQTS under kræftbehandling
Kardiovaskulær farmakoterapi
- ved afsluttet kræftbehandling anbefales en gennemgang af præparater opstartet i forbindelse med kardiotoksicitet eller som forebyggende tiltag
- ved seponering af præparater opstartet i forbindelse med kardiotoksicitet anbefales opfølgning for at sikre fortsat remission af den kardiovaskulære tilstand
- for patienter, der under kræftbehandling har udviklet kardiel dysfunktion, og hvor LV-funktion ikke er normaliseret under hjertesvigtsbehandling, anbefales langvarig behandling
- for patienter, der under kræftbehandling, har udviklet moderat til svær kardiel dysfunktion anbefales langvarig fastholdelse af denne behandling på trods af remission
41.6.3 Langtidsopfølgning og kroniske kardiovaskulære komplikationer
41.6.3.1 Specielle forhold vedrørende kræftoverlevere i barndom/ungdom
Kardiotoksicitet på baggrund af behandling med antracykliner, mitoxantrone og/eller mediastinal stråling kan udover kardiel dysfunktion, manifestere sig som klapsygdom, koronar sygdom, arytmier, autonom dysfunktion, perikardiesygdom og præmatur kardiovaskulær død. Manifestationer og risiko afhænger af den kumulerede dosis af såvel antracykliner og mediastinal bestråling. For denne gruppe patienter anbefales:
- årlig kontrol af kardiovaskulære risikofaktorer (kost, rygning, alkohol, motion, dyslipidæmi, hypertension og diabetes).
- en gennemgang af kardiovaskulær status i form af blodtryk, lipider, faste glukose, HbA1c, EKG og ekkokardiografi forud for graviditet eller senest i 1. trimester.
41.6.3.2 Myokardie-dysfunktion og hjertesvigt
Behandling af hjertesvigt hos patienter med tidligere kræft følger nuværende retningslinjer (se Kapitel 5: Kronisk hjertesvigt).
41.6.3.3 Koronarsygdom
Stråleterapi øger risikoen for både accelereret aterosklerose og stråleinduceret vaskulopati. Latenstiden varierer fra et par år til flere årtier afhængig af alder samt eksisterende aterosklerose forud for stråling. Ved mediastinal bestråling påvirkes hyppigst proksimale LAD og/eller RCA samt LIMA og RIMA.
Vaskulopatierne vil manifestere sig som svære, diffuse, lange, glatte og koncentriske angiografiske læsioner. Der er desuden påvist nedsat vævsheling i bestrålede områder.
41.6.3.4 Hjerteklapsygdom
Hjerteklapsygdom opstår typisk mere end 10 år efter afsluttet kræftbehandling. Mediastinal bestråling (typisk høje doser) er den største risikofaktor for stenose og/eller insufficiens blandt patienter med tidligere kræft. Op mod 40% af patienter med høj-dosis mediastinal bestråling får insufficiens, men under 10% får betydende hjerteklapsygdom. Behandling i henhold til Kapitel 6: Hjerteklapsygdom.
41.6.3.5 Perikardiesygdom
Risikoen for perikardiel komplikation i form af perikarditis efter brug af antracykliner, cyklosporin, cytarabin og bleomycin er ukendt, men menes at være lav. Langvarig dasatinib behandling er associeret med perikardieeksudat. Stråle-induceret kronisk perikardiesygdom kan opstå måneder til flere årtier efter, hvoraf constrictio cordis er den alvorligste. Ekkokardiografi anbefales som den primære diagnostisk modalitet. Se i øvrigt Kapitel 9: Perikardiesygdomme.
41.7 Særlige patientgrupper
41.7.1 Kardielle tumorer
Der henvises til Kapitel 10: Hjertetumorer.
41.7.2 Gravide patienter med malign sygdom
Gravide med malign sygdom udgør ca. 50-60 patienter om året i Danmark og følges på centre med højt specialiserede obstetrisk og onkologisk/hæmatologisk funktion.
Kardiel vurdering inkl. EKG og ekkokardiografi anbefales før potentielt kardiotoksisk kræftbehandling, samt hver til hver anden måned under behandlingsforløbet. Ekkokardiografien skal tolkes ud fra de fysiologiske ændringer i hæmodynamikken under graviditet. Der henvises til Kapitel 31: Graviditet og hjertesygdom
Der anbefales en multidisciplinær tilgang til disse patientforløb.
Venøs tromboemboli og lungeemboli forebygges og behandles som hos andre gravide med LMH. Se Kapitel 12: Lungeemboli og dyb venetrombose og Kapitel 14: Antikoagulationsbehandling.
41.7.3 Carcinoid klapsygdom
Carcinoid syndrom opstår på baggrund af primært neuroendokrine tumorer, som bl.a. producerer serotonin. Kardiel involvering kan være højresidig klapsygdom, sjældnere venstresidig klapsygdom, perikardieeksudat og kardielle metastaser. Koronar spasmer samt atriale og ventrikulære takyarytmier ses meget sjældent.
Patienter med carcinoid syndrom og kliniske tegn på kardiel involvering og/eller forhøjet pro-BNP bør udredes med ekkokardiografi. Beslutning om evt. operativ behandling hos patienter med forventet lang restlevetid bør diskuteres på MDT konference. Se i øvrigt Kapitel 6: Hjerteklapsygdom, Afsnit 6.6 Højresidig klapsygdom.
41.7.4 Patienter med kardiel device
Stråleenergi har større betydning for udvikling af pacemakersvigt end stråledosis. Svigt af ICD er relativt sjældent forekommende (1,5-7 %), ikke varigt, og som regel er der tale om resetting af ICD’en til nominel setting under stråling. Oversense af støj under stråleterapi forekommer ligeledes meget sjældent. Håndtering af patienten med en pacemaker bør før og efter stråleterapi håndteres efter nedenstående figur:
Figur 41.1: Håndtering af patienter med pacemaker før og efter stråleterapi |
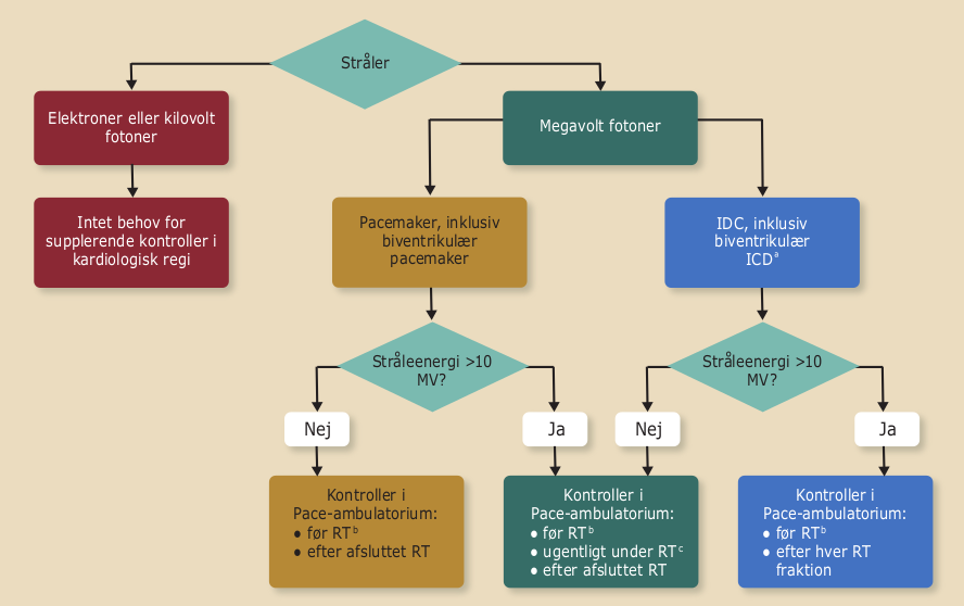 |
RT= radiation therapy (stråling) aOm muligt, hjemmemonitorering vælges frem for kontroller i pacemakerambulatoriet. bHvis sidste kontrol er mere end 3 måneder gammel. cÆndres til efter hver fraktion hvis der forekommer et reset. |
Det anbefales således ikke at omplacere eller inaktivere devicen, placere magnet på ICD-enheden under strålebehandling, inaktivere antitakykardi-terapien eller anvende telemetri under behandling. Anvendt stråleenergi skal sættes i relation til risiko for device-svigt og vurderes individuelt. Patienter med loop-recorder kan modtage strålebehandling. Loop-recordere skal aflæses før strålebehandling. Såfremt loop-recorderen er placeret direkte i strålefeltet, kan den eksplanteres.




